逐次反応においては,
\(\Large \require{AMScd} \begin{CD} A @>{k_B} >> B @>{k_C} >> C \end{CD} \)
となります.
これも,一次反応と同様にそれぞれの反応にかかる時間の和となるだけなので,
\(\Large t_{A \rightarrow C} = \frac{1}{k_B} + \frac{1}{k_C} \)
となります.
モンテカルロシュミレーションにて確認してみましょう.
解析的なとき方は,ここ,をご覧ください.

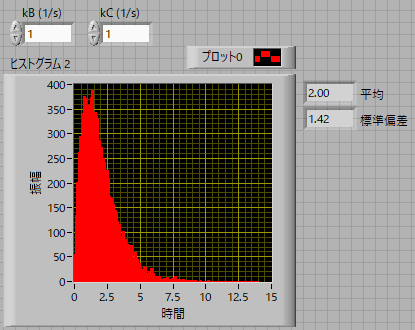
結果はこの通り,
kB = 1 (1/s), kC = 1 (1/s)
のとき,指数関数の差の分布となり,平均は2秒となります.
次に,競争反応について考えていきましょう.